【药品名称】通用名称:注射用头孢地嗪钠
英文名称:Cefodizime Sodium for Injection
汉语拼音:Zhusheyong Toubaodiqinna
【成份】本品主要成份为头孢地嗪钠,处方中未使用辅料。
化学名称:(6R,7R)-7-[(Z)-2-(2-氨基噻唑-4-基)-2-(甲氧亚氨基)乙酰氨基]-3-[(5-羧甲基-4-甲基噻唑-2-基)硫甲基]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸二钠盐。
化学结构式:
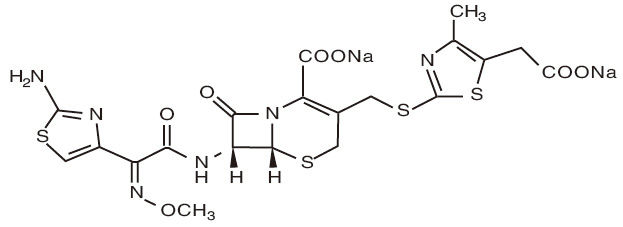
分子式:C20H18N6Na2O7S4
分子量:628.63
【性状】本品为白色至微黄色的粉末或结晶性粉末;无臭或稍有特异性气味。
【适应症】本品适用于对头孢地嗪敏感的链球菌、肺炎链球菌、淋球菌、卡他布兰汉菌、大肠埃希菌、柠檬酸杆菌、克雷伯杆菌、肠杆菌属、沙雷菌属、变形杆菌、莫尔加民摩根杆菌、普罗维登斯菌、流感嗜血杆菌、消化链球菌、类杆菌、普氏菌(除二路普氏菌)所引起的下述感染:上泌尿道感染、下泌尿道感染,下呼吸道感染及淋病。
【规格】按C20H20N6O7S4计算0.25g
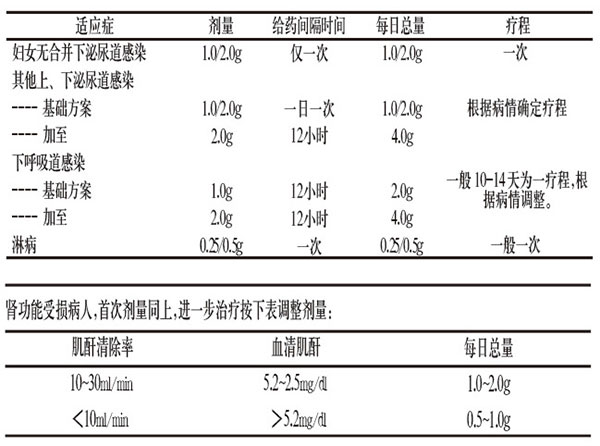
【用法用量】用法:静脉注射、静脉滴注、肌内注射。静脉注射:0.5g或1.0g注射用头孢地嗪钠溶于4ml注射用水,或2.0g注射用头孢地嗪钠溶于10ml注射用水中,于3~5分钟内注射。静脉输注:0.5g、1.0g或2.0g注射用头孢地嗪钠溶于40ml注射用水、生理盐水或林格氏液中,20~30分钟内输注。肌内注射:0.5g或1.0g注射用头孢地嗪钠溶于4ml注射用水,或2.0g注射用头孢地嗪钠溶于10ml注射用水中,臀肌深部注射。为防止疼痛,可将本品溶于1%利多卡因溶液中注射(此时须避免注入血管内)。用量见下表:
【不良反应】据文献介绍,经对使用注射用头孢地嗪钠的34666例不良反应进行评价,不良反应发生率为4.2%(1443例),主要不良反应为丙氨酸氨基转移酶(ALT)上升1.3%、天门冬酸氨基转移酶(AST)上升1.1%、肝功能异常0.7%、嗜酸性粒细胞增多0.6%、碱性磷酸酶(AIP)上升0.3%、γ-谷氨酰胺转肽酶( γ—GTP)上升0.3%、腹泻0.3%、发疹0.3%。详细情况如下:
1)重大不良反应[括号内记载的为发生频率。未记载的为发生频率不明]
①休克:可能引起休克,应密切观察,有异常发生时应停止给药,采取适当处置。②过敏反应:可能引起过敏反应(红斑、呼吸困难,水肿,痉挛等)(不到0.1%),应密切观察,有异常发生时应停止给药,采取适当处置。③急性肾功能衰竭:可能引起急性肾功能衰竭(不到0.1%),因此应密切观察,例如进行定期检查等,有异常发生时应停止给药,采取适当处置。④伪膜性结肠炎:可能引起伴有血便的严重大肠炎例如伪膜性结肠炎等(不到0.1%)。如有腹痛、反复腹泻出现时,应立即停止给药,采取适当处置。⑤粒细胞缺乏症,血小板减少:可能引起粒细胞缺乏症,血小板减少(不到0.1%),因此应密切观察,例如进行定期检查等,有异常发生时应停止给药,采取适当处置。⑥中毒性表皮坏死溶解症(Lye11症候群)、皮肤粘膜眼症候群(Stevens-Johnson症侯群):可能引起中毒性表皮坏死溶解症、皮肤粘膜眼症候群,应密切观察,有异常发生时应停止给药,采取适当处置。
2)重大的不良反应(同类药)①全血细胞减少,溶血性贫血:因为其他头孢类抗生素有出现全血细胞减少,溶血性贫血的报告,应密切观察。例如进行定期检查等,有异常发生时应停止给药,采取适当处置。②间质性肺炎,伴有嗜酸性细胞增多非浸润(PIE)的综合征:因为其他头孢类抗生素有出现伴有发热、咳嗽、呼吸困难、胸部X线异常,嗜酸细胞增多等症状的间质性肺炎,PIE的综合征的报告,应密切观察。如有上述症状发生应停止给药,采取给予糖皮质激素等适当处置。
3)其他不良反应
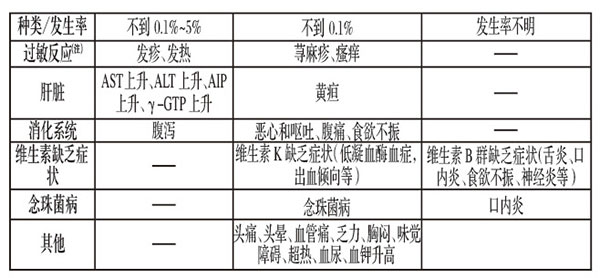
注)有异常发生时应停止给药,采取适当处置
【禁忌】对本品或头孢菌素类过敏者禁用。肌内注射时,对利多卡因或氨基类局部麻醉药过敏者禁用。
【注意事项】1.在使用本品前应仔细询问患者是否曾有过头孢地嗪钠、头孢菌素类抗生素、青霉素或者其他药物的过敏史。下列患者慎用本品:对青霉素类抗生素有过敏史的患者;患者本人或双亲、兄弟有易引起支气管哮喘、皮疹、荨麻疹等过敏症状体质患者;严重肾功能衰竭的患者;肝功能损害患者;口服摄食不足或非口服维持营养者、全身状态不良患者。2.本品溶解后应尽早使用,不得放置。3.在葡萄糖溶液中不能长期保持稳定,应立即注射。4.不易溶于乳酸钠溶液中。5.不能与其它抗生素在同一溶液混合。6.与青霉素或其它β-内酰胺类抗生素存在交叉过敏的可能。7.发生过敏性休克时,应立即停止注射,保留静脉插管或重新建立静脉插管,保持病人卧位,双腿抬高,气道通畅;紧急时立即静脉注射肾上腺素,继而给予糖皮质激素静脉注射,如250~1000mg甲基强的松龙,可重复给药,随后静脉注射容量代用品;必要时采用人工呼吸、吸氧、抗组胺药等治疗措施。8.除试纸反应以外,对斑氏(Benedict)试剂,亚铁(Fehling)试剂,尿糖试药丸(Clinitest)进行尿糖检查,有假阳性出现的可能性,有出现直接库姆斯试验阳性的可能性,应予以注意。9.当与甲磺酸加贝酯制剂混合后可能会出现混浊或沉淀,应避免混合使用。10.当与氨茶碱制剂混合时,随着时间的推移可能会出现明显的药物活性下降,混合后应迅速使用。
【孕妇及哺乳期妇女用药】1.虽然动物试验未发现本品对胎仔有致畸或毒性作用,但妊娠时给药的安全性尚未肯定。对于孕妇,尤其是在妊娠最初三个月内的妇女,或可能妊娠的妇女,只有当治疗的益处大于危险时,方可给药。2.本品可通过乳汁排泌,哺乳期妇女应避免使用,如需使用,给药期间应该避免哺乳。
【儿童用药】儿童通常用量为1日60~80mg/kg,分3~4次静脉注射或滴注。对于难治性或重症感染症的儿童可增至一日120mg/kg,分次给药。低出生体重儿、新生儿用药的安全性尚未确立。
【老年用药】1.老年者多见生理功能降低,易出现副作用。如老年者可从1.25g开始给药,慎重给药。2.老年者有可能出现维生素K缺乏引起的出血倾向。
【药物相互作用】1.与丙磺舒合用可延迟本品的排泄。2.本品可加强具有潜在肾毒性药物的毒性作用,如与氨基糖苷类、两性霉素B、环孢素、顺铂、万古霉素、多粘菌素B或粘菌素同时或先后使用时,应密切监测肾功能。使用强效利尿剂,如速尿的患者,大剂量使用头孢菌素治疗可以引起肾功能损伤。
【药物过量】尚不明确。
【药理毒理】本品为第三代注射用头孢菌素类抗生素。通过抑制细菌细胞壁的合成发挥杀菌作用。本品主要对多种G+和G-菌和厌氧菌有效。体外试验表明,本品对以下病原菌敏感:如金黄色葡萄球菌(不包括对甲氧苯青霉素耐药菌株)、链球菌属、肺炎球菌、淋病奈瑟菌(包括产β-内酰胺酶的菌株)、脑膜炎奈瑟菌、卡他布兰汉菌、大肠埃希菌、志贺菌属、沙门菌属、枸橼酸杆菌属、克雷伯菌属、普通变形杆菌、普鲁威登菌属、摩氏摩根氏菌、嗜血流感杆菌、棒状杆菌属。本品对大多数细菌产生的β-内酰胺酶稳定。本品对类杆菌属、不动杆菌属、粪肠球菌、李斯特菌属、支原体、衣原体无效。
【药代动力学】本品单次静脉注射和滴注本品0.5~2g后,平均高峰血药浓度分别可达133~394mg/L,肌注后生物利用度可达90%~100%。平均消除半衰期多为2.5小时左右,老年患者和肾功能减退者半衰期可延长。本品平均蛋白结合率为81%~88%,随浓度增高而降低。本品可分布进入腹水、胆汁、脑脊液、肺、肾、子宫内膜及其它盆腔组织等各种体液和组织。在体内不被代谢,给药量的51%~94%于48小时内以原形从尿中排出。多次给药后,粪便中可排出给药量的11%~30%,胆汁中浓度甚高。
文献报道的详细的本品药代动力学研究情况如下:
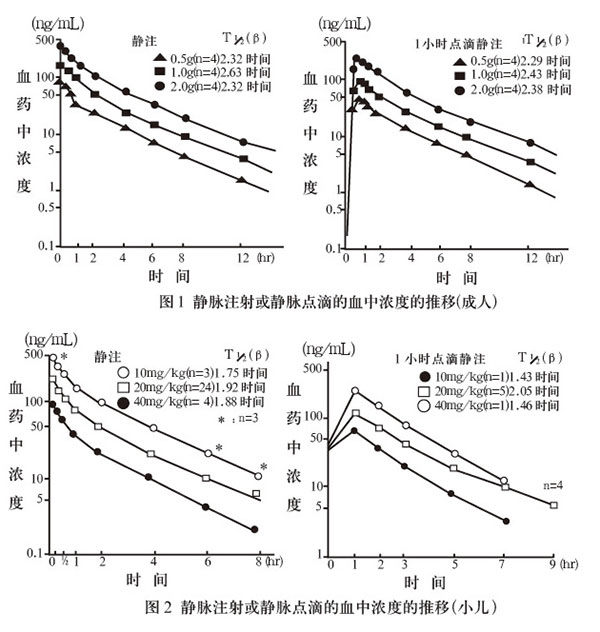
1.血中浓度
健康成人及小儿患者1次静脉注射或1小时静脉点滴的血中浓度的推移如图1及图2所示,呈现用量依存性变化。
2.组织内移行
1)咳痰中的移行
支气管炎等患者本品1g及2g以1小时静脉点滴,咳痰中的浓度最高值分别为1.23±1.51μg/mL及2.68±2.05μg/mL。
2)胆囊组织·胆汁中移行
胆囊摘出术患者本品1g术前静脉点滴,2~5小时后摘出的胆囊组织及胆汁中浓度分别为72.1±41.0μ g/g及1530土1300μg/mL。
3)腹腔内渗出液中移行
胆囊摘出术患者本品每次1g,1日2次,3日静脉内给药时的腹腔内渗出液中浓度在术后第1、2、3日均于给药后3小时达最高值,分别为28.0±8.3μg/mL、39.3±11.4μg/mL、40.9±10.2μg/mL。
4)耳漏中移行
患者本品1g静脉内给药,耳漏中浓度(平均)值于给药1小时后为2.45μg/g,2小时后达最高值为
14.07μg/g。
5)女性生殖组织内移行
女生患者本品1g静脉内给药时的生殖组织(输卵管,卵巢,子宫内膜,子宫肌层,子宫颈和子宫阴道部)中浓度于静注结束后0.35~1.86小时达最高值19.15~36.06μg/g。
6)髓液中移行
髓膜炎小儿患者本品50mg/kg1日或8日静脉内注射时,髓液中浓度于静注结束后0.25~6.5小时为0.76~9.48μg/mL。
3.代谢
健康成人本品1g以1小时静脉点滴,血浆及尿中未显示有抗菌活性的代谢物。
4.排泄
健康成人本品1g1次静脉注射给药,主要通过肾脏排泄,至8小时及24小时的尿中排泄率分别为给药量的69.14±10.59%及77.39±11.43%。此外,至72小时的粪中排泄率为7.66%以下。
5.肾功能障碍时的血中浓度·尿中排泄
在肾功能低下患者中,呈现肾功能低下依赖性的血中浓度上升和血中半衰期延长,而且,尿中排泄率也下降。因此,肾功能障碍患者本品给药时应适当调整给药剂量和给药间隔。
【贮藏】密封,在凉暗(避光并不超过20℃)干燥处保存。
【包装】西林瓶装,10支/盒。
【有效期】24个月
【执行标准】《中国药典》2015年版二部
【批准文号】国药准字H20123251
【生产企业】企业名称:山西振东泰盛制药有限公司
生产地址:山西省大同市经济技术开发区第一医药园区
邮政编码:037300
电话号码:0352-7290991
传真号码:0352-7290990

【药品名称】通用名称:注射用头孢地嗪钠
英文名称:Cefodizime Sodium for Injection
汉语拼音:Zhusheyong Toubaodiqinna
【成份】本品主要成份为头孢地嗪钠,处方中未使用辅料。
化学名称:(6R,7R)-7-[(Z)-2-(2-氨基噻唑-4-基)-2-(甲氧亚氨基)乙酰氨基]-3-[(5-羧甲基-4-甲基噻唑-2-基)硫甲基]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸二钠盐。
化学结构式:

分子式:C20H18N6Na2O7S4
分子量:628.63
【性状】本品为白色至微黄色的粉末或结晶性粉末;无臭或稍有特异性气味。
【适应症】本品适用于对头孢地嗪敏感的链球菌、肺炎链球菌、淋球菌、卡他布兰汉菌、大肠埃希菌、柠檬酸杆菌、克雷伯杆菌、肠杆菌属、沙雷菌属、变形杆菌、莫尔加民摩根杆菌、普罗维登斯菌、流感嗜血杆菌、消化链球菌、类杆菌、普氏菌(除二路普氏菌)所引起的下述感染:上泌尿道感染、下泌尿道感染,下呼吸道感染及淋病。
【规格】按C20H20N6O7S4计算0.25g
【用法用量】用法:静脉注射、静脉滴注、肌内注射。静脉注射:0.5g或1.0g注射用头孢地嗪钠溶于4ml注射用水,或2.0g注射用头孢地嗪钠溶于10ml注射用水中,于3~5分钟内注射。静脉输注:0.5g、1.0g或2.0g注射用头孢地嗪钠溶于40ml注射用水、生理盐水或林格氏液中,20~30分钟内输注。肌内注射:0.5g或1.0g注射用头孢地嗪钠溶于4ml注射用水,或2.0g注射用头孢地嗪钠溶于10ml注射用水中,臀肌深部注射。为防止疼痛,可将本品溶于1%利多卡因溶液中注射(此时须避免注入血管内)。用量见下表:

【不良反应】据文献介绍,经对使用注射用头孢地嗪钠的34666例不良反应进行评价,不良反应发生率为4.2%(1443例),主要不良反应为丙氨酸氨基转移酶(ALT)上升1.3%、天门冬酸氨基转移酶(AST)上升1.1%、肝功能异常0.7%、嗜酸性粒细胞增多0.6%、碱性磷酸酶(AIP)上升0.3%、γ-谷氨酰胺转肽酶( γ—GTP)上升0.3%、腹泻0.3%、发疹0.3%。详细情况如下:
1)重大不良反应[括号内记载的为发生频率。未记载的为发生频率不明]
①休克:可能引起休克,应密切观察,有异常发生时应停止给药,采取适当处置。②过敏反应:可能引起过敏反应(红斑、呼吸困难,水肿,痉挛等)(不到0.1%),应密切观察,有异常发生时应停止给药,采取适当处置。③急性肾功能衰竭:可能引起急性肾功能衰竭(不到0.1%),因此应密切观察,例如进行定期检查等,有异常发生时应停止给药,采取适当处置。④伪膜性结肠炎:可能引起伴有血便的严重大肠炎例如伪膜性结肠炎等(不到0.1%)。如有腹痛、反复腹泻出现时,应立即停止给药,采取适当处置。⑤粒细胞缺乏症,血小板减少:可能引起粒细胞缺乏症,血小板减少(不到0.1%),因此应密切观察,例如进行定期检查等,有异常发生时应停止给药,采取适当处置。⑥中毒性表皮坏死溶解症(Lye11症候群)、皮肤粘膜眼症候群(Stevens-Johnson症侯群):可能引起中毒性表皮坏死溶解症、皮肤粘膜眼症候群,应密切观察,有异常发生时应停止给药,采取适当处置。
2)重大的不良反应(同类药)①全血细胞减少,溶血性贫血:因为其他头孢类抗生素有出现全血细胞减少,溶血性贫血的报告,应密切观察。例如进行定期检查等,有异常发生时应停止给药,采取适当处置。②间质性肺炎,伴有嗜酸性细胞增多非浸润(PIE)的综合征:因为其他头孢类抗生素有出现伴有发热、咳嗽、呼吸困难、胸部X线异常,嗜酸细胞增多等症状的间质性肺炎,PIE的综合征的报告,应密切观察。如有上述症状发生应停止给药,采取给予糖皮质激素等适当处置。
3)其他不良反应

注)有异常发生时应停止给药,采取适当处置
【禁忌】对本品或头孢菌素类过敏者禁用。肌内注射时,对利多卡因或氨基类局部麻醉药过敏者禁用。
【注意事项】1.在使用本品前应仔细询问患者是否曾有过头孢地嗪钠、头孢菌素类抗生素、青霉素或者其他药物的过敏史。下列患者慎用本品:对青霉素类抗生素有过敏史的患者;患者本人或双亲、兄弟有易引起支气管哮喘、皮疹、荨麻疹等过敏症状体质患者;严重肾功能衰竭的患者;肝功能损害患者;口服摄食不足或非口服维持营养者、全身状态不良患者。2.本品溶解后应尽早使用,不得放置。3.在葡萄糖溶液中不能长期保持稳定,应立即注射。4.不易溶于乳酸钠溶液中。5.不能与其它抗生素在同一溶液混合。6.与青霉素或其它β-内酰胺类抗生素存在交叉过敏的可能。7.发生过敏性休克时,应立即停止注射,保留静脉插管或重新建立静脉插管,保持病人卧位,双腿抬高,气道通畅;紧急时立即静脉注射肾上腺素,继而给予糖皮质激素静脉注射,如250~1000mg甲基强的松龙,可重复给药,随后静脉注射容量代用品;必要时采用人工呼吸、吸氧、抗组胺药等治疗措施。8.除试纸反应以外,对斑氏(Benedict)试剂,亚铁(Fehling)试剂,尿糖试药丸(Clinitest)进行尿糖检查,有假阳性出现的可能性,有出现直接库姆斯试验阳性的可能性,应予以注意。9.当与甲磺酸加贝酯制剂混合后可能会出现混浊或沉淀,应避免混合使用。10.当与氨茶碱制剂混合时,随着时间的推移可能会出现明显的药物活性下降,混合后应迅速使用。
【孕妇及哺乳期妇女用药】1.虽然动物试验未发现本品对胎仔有致畸或毒性作用,但妊娠时给药的安全性尚未肯定。对于孕妇,尤其是在妊娠最初三个月内的妇女,或可能妊娠的妇女,只有当治疗的益处大于危险时,方可给药。2.本品可通过乳汁排泌,哺乳期妇女应避免使用,如需使用,给药期间应该避免哺乳。
【儿童用药】儿童通常用量为1日60~80mg/kg,分3~4次静脉注射或滴注。对于难治性或重症感染症的儿童可增至一日120mg/kg,分次给药。低出生体重儿、新生儿用药的安全性尚未确立。
【老年用药】1.老年者多见生理功能降低,易出现副作用。如老年者可从1.25g开始给药,慎重给药。2.老年者有可能出现维生素K缺乏引起的出血倾向。
【药物相互作用】1.与丙磺舒合用可延迟本品的排泄。2.本品可加强具有潜在肾毒性药物的毒性作用,如与氨基糖苷类、两性霉素B、环孢素、顺铂、万古霉素、多粘菌素B或粘菌素同时或先后使用时,应密切监测肾功能。使用强效利尿剂,如速尿的患者,大剂量使用头孢菌素治疗可以引起肾功能损伤。
【药物过量】尚不明确。
【药理毒理】本品为第三代注射用头孢菌素类抗生素。通过抑制细菌细胞壁的合成发挥杀菌作用。本品主要对多种G+和G-菌和厌氧菌有效。体外试验表明,本品对以下病原菌敏感:如金黄色葡萄球菌(不包括对甲氧苯青霉素耐药菌株)、链球菌属、肺炎球菌、淋病奈瑟菌(包括产β-内酰胺酶的菌株)、脑膜炎奈瑟菌、卡他布兰汉菌、大肠埃希菌、志贺菌属、沙门菌属、枸橼酸杆菌属、克雷伯菌属、普通变形杆菌、普鲁威登菌属、摩氏摩根氏菌、嗜血流感杆菌、棒状杆菌属。本品对大多数细菌产生的β-内酰胺酶稳定。本品对类杆菌属、不动杆菌属、粪肠球菌、李斯特菌属、支原体、衣原体无效。
【药代动力学】本品单次静脉注射和滴注本品0.5~2g后,平均高峰血药浓度分别可达133~394mg/L,肌注后生物利用度可达90%~100%。平均消除半衰期多为2.5小时左右,老年患者和肾功能减退者半衰期可延长。本品平均蛋白结合率为81%~88%,随浓度增高而降低。本品可分布进入腹水、胆汁、脑脊液、肺、肾、子宫内膜及其它盆腔组织等各种体液和组织。在体内不被代谢,给药量的51%~94%于48小时内以原形从尿中排出。多次给药后,粪便中可排出给药量的11%~30%,胆汁中浓度甚高。
文献报道的详细的本品药代动力学研究情况如下:

1.血中浓度
健康成人及小儿患者1次静脉注射或1小时静脉点滴的血中浓度的推移如图1及图2所示,呈现用量依存性变化。
2.组织内移行
1)咳痰中的移行
支气管炎等患者本品1g及2g以1小时静脉点滴,咳痰中的浓度最高值分别为1.23±1.51μg/mL及2.68±2.05μg/mL。
2)胆囊组织·胆汁中移行
胆囊摘出术患者本品1g术前静脉点滴,2~5小时后摘出的胆囊组织及胆汁中浓度分别为72.1±41.0μ g/g及1530土1300μg/mL。
3)腹腔内渗出液中移行
胆囊摘出术患者本品每次1g,1日2次,3日静脉内给药时的腹腔内渗出液中浓度在术后第1、2、3日均于给药后3小时达最高值,分别为28.0±8.3μg/mL、39.3±11.4μg/mL、40.9±10.2μg/mL。
4)耳漏中移行
患者本品1g静脉内给药,耳漏中浓度(平均)值于给药1小时后为2.45μg/g,2小时后达最高值为
14.07μg/g。
5)女性生殖组织内移行
女生患者本品1g静脉内给药时的生殖组织(输卵管,卵巢,子宫内膜,子宫肌层,子宫颈和子宫阴道部)中浓度于静注结束后0.35~1.86小时达最高值19.15~36.06μg/g。
6)髓液中移行
髓膜炎小儿患者本品50mg/kg1日或8日静脉内注射时,髓液中浓度于静注结束后0.25~6.5小时为0.76~9.48μg/mL。
3.代谢
健康成人本品1g以1小时静脉点滴,血浆及尿中未显示有抗菌活性的代谢物。
4.排泄
健康成人本品1g1次静脉注射给药,主要通过肾脏排泄,至8小时及24小时的尿中排泄率分别为给药量的69.14±10.59%及77.39±11.43%。此外,至72小时的粪中排泄率为7.66%以下。
5.肾功能障碍时的血中浓度·尿中排泄
在肾功能低下患者中,呈现肾功能低下依赖性的血中浓度上升和血中半衰期延长,而且,尿中排泄率也下降。因此,肾功能障碍患者本品给药时应适当调整给药剂量和给药间隔。
【贮藏】密封,在凉暗(避光并不超过20℃)干燥处保存。
【包装】西林瓶装,10支/盒。
【有效期】24个月
【执行标准】《中国药典》2015年版二部
【批准文号】国药准字H20123251
【生产企业】企业名称:山西振东泰盛制药有限公司
生产地址:山西省大同市经济技术开发区第一医药园区
邮政编码:037300
电话号码:0352-7290991
传真号码:0352-7290990



