
【药品名称】通用名:注射用培美曲塞二钠
英文名:Pemetrexed Disodium for Injection
汉语拼音:Zhusheyong Peimeiqusaierna
【成份】本品主要成份是培美曲塞二钠,其化学名称为N-[4-[2-(2-氨基-4,7-二氢-4-氧-1H-吡咯[2,3-d]-嘧啶-5-基)乙基]苯甲酰]-L-谷氨酸二钠盐二分之五水合物。辅料为甘露醇。
化学结构式:
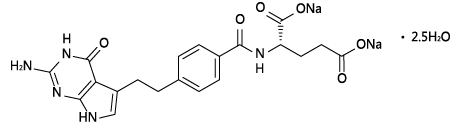
分子式:C20H19N5Na2O6·2.5H2O
分子量:516.38
【性状】本品为白色或类白色至淡黄色或绿黄色疏松块状物。
【适应症】非小细胞肺癌:本品单药适用于既往接受一线化疗后出现进展的局部晚期或转移性非鳞状细胞型非小细胞肺癌患者的治疗。本品单药适用于经4个周期以铂类为基础的一线化疗后未出现进展的局部晚期或转移性的非鳞状细胞型非小细胞肺癌患者的维持治疗。这里一线化疗主要是指铂类与吉西他滨、紫杉醇或多西他赛的二联化疗。目前尚未获得比较一线化疗后未进展和进展后使用培美曲塞的临床研究数据。不推荐本品在以组织学为鳞状细胞癌型为主的患者中使用。恶性胸膜间皮瘤:适用于与顺铂联合治疗无法手术的恶性胸膜间皮瘤。
【规格】0.5g(以C20H19N5O6)计。
【用法用量】本品必须在有抗肿瘤化疗应用经验的合格医师的指导下使用。本品只能用于静脉输注。其溶液的配制必须按照“静脉输注溶液的配制”的说明进行。(详见药品说明书)
【不良反应】由于各临床试验条件差异很大,不良反应率不能直接用于与其它临床试验的不良反应率相比,也不可能反映出临床实践中观察到的不良反应率。在临床试验中,采用培美曲塞单药治疗时的最常见不良反应(发生率≥20%)有乏力、恶心和食欲减退。当培美曲塞与顺铂联用时,增加的常见不良反应(发生率≥20%)包括呕吐、嗜中性粒细胞减少、白细胞减少、贫血、口腔炎/咽炎、血小板减少和便秘。
【禁忌】对培美曲塞或该制剂中的任何其它成份有重度过敏史的患者,禁忌使用培美曲塞。禁忌同时接种黄热病疫苗(参见【药物相互作用】)。
【注意事项】详见药品说明书。
【孕妇及哺乳期妇女用药】妊娠:根据培美曲塞的作用机制,妊娠妇女接受培美曲塞时可能会导致对胎儿的伤害。尚未在妊娠妇女中开展充分的培美曲塞对照试验。在小鼠中,培美曲塞有胚胎毒性、胎儿毒性和致畸性。在器官发生过程中,小鼠接受培美曲塞重复腹腔给药,可导致鼠胎畸形(距骨和颅骨骨化不全;以mg/㎡计,大约为推荐人静脉给药剂量的1/833)和腭裂(以mg/㎡计,大约为推荐人静脉给药剂量的1/33)。胚胎毒性可表现为胚胎死亡增加和产仔数下降。如果在妊娠中使用培美曲塞,或如果患者在使用该药过程中妊娠,应向患者告知对胎儿的潜在危险。应建议有生育可能的女性在培美曲塞治疗过程中使用有效的避孕措施以避免妊娠。哺乳期妇女:尚不清楚培美曲塞是否能从乳汁中分泌。由于许多药物会从乳汁中分泌,而且培美曲塞可能会对哺乳婴儿产生潜在的严重不良反应,在充分考虑药物对母亲的重要性后,应决定中止哺乳或中止药物。
【儿童用药】尚未确定培美曲塞在儿科患者中的安全性和有效性。
【老年用药】已知培美曲塞通过肾脏大量排泄,因此在肾功能损害患者中,发生不良药物反应的风险可能会升高。因为老年患者更可能会发生肾功能下降,应谨慎选择剂量。建议在培美曲塞给药时进行肾功能监测。除对所有患者给予的减量建议外,不需要在65岁或以上患者中降低剂量(见【用法用量】)。
【药物相互作用】详见药品说明书。
【药物过量】培美曲塞过量的报告很少。报告的毒性包括嗜中性粒细胞减少症、贫血、血小板减少、粘膜炎和皮疹。药物过量的预期并发症包括骨髓抑制,可表现为嗜中性粒细胞减少、血小板减少和贫血。此外,也可见到伴或不伴发热的感染、腹泻和粘膜炎。如果发生药物过量,治疗医生应根据需要采取常规的支持治疗措施。
【药理毒理】详见药品说明书。
【药代动力学】详见药品说明书。
【贮藏】遮光、密封、在凉暗(避光并不超过20℃)处保存。
【包装】西林瓶装。1支/盒。
【有效期】24个月
【执行标准】YBH04242008
【批准文号】国药准字H20080249
【上市许可持有人】名称:山西振东泰盛制药有限公司
注册地址:山西省大同市经济技术开发区第一医药园区
【生产企业】企业名称:山西振东泰盛制药有限公司
生产地址:山西省大同市经济技术开发区第一医药园区
邮政编码:037300
电话号码:0352—7290991
传真号码:0352—7290990

【药品名称】通用名:注射用培美曲塞二钠
英文名:Pemetrexed Disodium for Injection
汉语拼音:Zhusheyong Peimeiqusaierna
【成份】本品主要成份是培美曲塞二钠,其化学名称为N-[4-[2-(2-氨基-4,7-二氢-4-氧-1H-吡咯[2,3-d]-嘧啶-5-基)乙基]苯甲酰]-L-谷氨酸二钠盐二分之五水合物。辅料为甘露醇。
化学结构式:

分子式:C20H19N5Na2O6·2.5H2O
分子量:516.38
【性状】本品为白色或类白色至淡黄色或绿黄色疏松块状物。
【适应症】非小细胞肺癌:本品单药适用于既往接受一线化疗后出现进展的局部晚期或转移性非鳞状细胞型非小细胞肺癌患者的治疗。本品单药适用于经4个周期以铂类为基础的一线化疗后未出现进展的局部晚期或转移性的非鳞状细胞型非小细胞肺癌患者的维持治疗。这里一线化疗主要是指铂类与吉西他滨、紫杉醇或多西他赛的二联化疗。目前尚未获得比较一线化疗后未进展和进展后使用培美曲塞的临床研究数据。不推荐本品在以组织学为鳞状细胞癌型为主的患者中使用。恶性胸膜间皮瘤:适用于与顺铂联合治疗无法手术的恶性胸膜间皮瘤。
【规格】0.5g(以C20H19N5O6)计。
【用法用量】本品必须在有抗肿瘤化疗应用经验的合格医师的指导下使用。本品只能用于静脉输注。其溶液的配制必须按照“静脉输注溶液的配制”的说明进行。(详见药品说明书)
【不良反应】由于各临床试验条件差异很大,不良反应率不能直接用于与其它临床试验的不良反应率相比,也不可能反映出临床实践中观察到的不良反应率。在临床试验中,采用培美曲塞单药治疗时的最常见不良反应(发生率≥20%)有乏力、恶心和食欲减退。当培美曲塞与顺铂联用时,增加的常见不良反应(发生率≥20%)包括呕吐、嗜中性粒细胞减少、白细胞减少、贫血、口腔炎/咽炎、血小板减少和便秘。
【禁忌】对培美曲塞或该制剂中的任何其它成份有重度过敏史的患者,禁忌使用培美曲塞。禁忌同时接种黄热病疫苗(参见【药物相互作用】)。
【注意事项】详见药品说明书。
【孕妇及哺乳期妇女用药】妊娠:根据培美曲塞的作用机制,妊娠妇女接受培美曲塞时可能会导致对胎儿的伤害。尚未在妊娠妇女中开展充分的培美曲塞对照试验。在小鼠中,培美曲塞有胚胎毒性、胎儿毒性和致畸性。在器官发生过程中,小鼠接受培美曲塞重复腹腔给药,可导致鼠胎畸形(距骨和颅骨骨化不全;以mg/㎡计,大约为推荐人静脉给药剂量的1/833)和腭裂(以mg/㎡计,大约为推荐人静脉给药剂量的1/33)。胚胎毒性可表现为胚胎死亡增加和产仔数下降。如果在妊娠中使用培美曲塞,或如果患者在使用该药过程中妊娠,应向患者告知对胎儿的潜在危险。应建议有生育可能的女性在培美曲塞治疗过程中使用有效的避孕措施以避免妊娠。哺乳期妇女:尚不清楚培美曲塞是否能从乳汁中分泌。由于许多药物会从乳汁中分泌,而且培美曲塞可能会对哺乳婴儿产生潜在的严重不良反应,在充分考虑药物对母亲的重要性后,应决定中止哺乳或中止药物。
【儿童用药】尚未确定培美曲塞在儿科患者中的安全性和有效性。
【老年用药】已知培美曲塞通过肾脏大量排泄,因此在肾功能损害患者中,发生不良药物反应的风险可能会升高。因为老年患者更可能会发生肾功能下降,应谨慎选择剂量。建议在培美曲塞给药时进行肾功能监测。除对所有患者给予的减量建议外,不需要在65岁或以上患者中降低剂量(见【用法用量】)。
【药物相互作用】详见药品说明书。
【药物过量】培美曲塞过量的报告很少。报告的毒性包括嗜中性粒细胞减少症、贫血、血小板减少、粘膜炎和皮疹。药物过量的预期并发症包括骨髓抑制,可表现为嗜中性粒细胞减少、血小板减少和贫血。此外,也可见到伴或不伴发热的感染、腹泻和粘膜炎。如果发生药物过量,治疗医生应根据需要采取常规的支持治疗措施。
【药理毒理】详见药品说明书。
【药代动力学】详见药品说明书。
【贮藏】遮光、密封、在凉暗(避光并不超过20℃)处保存。
【包装】西林瓶装。1支/盒。
【有效期】24个月
【执行标准】YBH04242008
【批准文号】国药准字H20080249
【上市许可持有人】名称:山西振东泰盛制药有限公司
注册地址:山西省大同市经济技术开发区第一医药园区
【生产企业】企业名称:山西振东泰盛制药有限公司
生产地址:山西省大同市经济技术开发区第一医药园区
邮政编码:037300
电话号码:0352—7290991
传真号码:0352—7290990



